

③反响Ⅱ在2min时到达平衡,平衡常数K(Ⅱ)=12.在体积和温度不变的条件下,在上述反响到达平衡Ⅱ时,再往容器中参加1molCO和3molCH
3)的凹凸:T1>T3(填“>”“<”“=”),判别的理由是此反响为放热反响,下降温度,反响速率减慢,平衡向正反响方向移动.(2)某研究所拼装的CH3OH-O
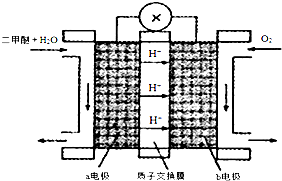
2燃料电池的作业原理如图2所示.①该电池负极的电极反响式为:CH3OH-6e
-+H2O=CO2↑+6H+;.②以此电池作电源进行电解,设备如图3所示.发现溶液逐突变污浊并有气泡产生,其原因是Al-3e-=Al
②恒温恒容下,压强之比等于气体物质的量之比,故平衡时混合气体总物质的量为(2+4)mol×$\frac{1.0aKPa}{2.0aKPa}$=3mol,则:CO(g)+2H2
③Ⅱ、Ⅰ温度相同,平衡常数相同,依据K=$\frac{c(C{H}_{3}OH)}{c(CO){c}^{2}({H}_{2})}$核算平衡常数;核算此刻浓度商Qc,若Qc=K,处于平衡状况,若Qc<K,反响向正反响进行,若Qc>K,反响向逆反响进行;④反响Ⅲ达平衡时所用的时间比反响Ⅰ达平衡时所用的时间长,化学反响速率快,且Ⅲ平衡时压强比I小,与I比较平衡正向移动,正反响为气体体积减小放热反响,应下降温度;
(2)①甲醇产生氧化反响,在负极反响酸溶液中失电子生成二氧化碳,据此书写电极反响,再从氢离子移动方向剖析.正极是氧气在反响,留意电解质是酸性的;
故答案为:Ⅱ中运用催化剂;②恒温恒容下,压强之比等于气体物质的量之比,故平衡时混合气体总物质的量为(2+4)mol×$\frac{1.0aKPa}{2.0aKPa}$=3mol,则:CO(g)+2H
④反响Ⅲ达平衡时所用的时间比反响Ⅰ达平衡时所用的时间长,化学反响速率快,且Ⅲ平衡时压强比I小,与I比较平衡正向移动,正反响为气体体积减小放热反响,应下降温度,故温度T
故答案为:>;此反响为放热反响,下降温度,反响速率减慢,平衡向正反响方向移动;(2)①H向右移动,阐明右面的电极是正极,故甲醇应从b也便是负极通入.甲烷失电子生成二氧化碳产生氧化反响,负极电极反响为:CH3
-;阳极上生成的铝离子和碳酸氢根离子产生双水解反响生成氢氧化铝沉积和二氧化碳气体,所以溶液变污浊Al3++3HCO3-=Al(OH)3↓+3CO2↑,故答案为:Al-3e-=Al
高中化学来历:题型:填空题18.用20g氢氧化钠配成250mL溶液,其物质的量浓度为2mol/L;从中取出5mL溶液,加水稀释为100mL,则稀释后溶液的物质的量浓度为0.1mol/L,在这100mL溶液中含NaOH的质量为0.4g.
高中化学来历:题型:选择题2.下列各组离子,在强碱性溶液中能够很多共存的是()
高中化学来历:题型:解答题8.对燃煤烟气和轿车尾气进行脱硝、脱碳和脱硫等处理,可完成绿色环保、节能减排等意图.轿车尾气脱硝脱碳的首要原理为:2NO(g)+2CO(g)$\stackrel{催化剂}{?}$N
)=0.09mol/(Ls)(保存两位小数,下同);此温度下,该反响的平衡常数为0.03molL
2SO4固体,$\frac{c(N{{H}_{4}}^{+})}{c(S{{O}_{4}}^{2-})}$的值将变大(填“变大”、“不变”或“变小”)(4)规划如图1设备模仿传感器测定CO与NO反响原理.①铂电极为正极(填“正极”或“负极”).②负极电极反响式为CO+O
-=CO2III、如图2所示,无冲突、无质量的活塞1、2将反响器隔成甲、乙两部分,在25℃和101kPa下完成平衡时,各部分体积分别为V甲、V
乙.此刻若去掉活塞1,不引起活塞2的移动.则x=1.5,V甲:V乙=3:1.检查答案和解析
3OCH3(g)+CO2(g)△H=-246.1kJmol-1.830℃时反响③的K=1.0,则在催化反响室中反响③的K>1.0(填“>”、“<”或“=”).(2)在某温度下,若反响①的开始浓度分别为:c(CO)=1mol/L、c(H2
3OCH3(g)+H2O(g)在某温度下的平衡常数为400.此温度下,在密闭容器中参加CH3OH,反响到某时间测得各组分的浓度如下:
3OH)=0.04molL-1.(4)“二甲醚燃料电池”是一种绿色电源,其间作业原理如图所示.①该电池a电极上产生的电极反响式CH
-3molL-1min-1,NO的转化率α1=75%.其他条件坚持不变,反响(Ⅱ)在恒压条件下进行,平衡时NO的转化率α2>α1(填“>”“<”或“=”).(3)轿车运用乙醇汽油并不能削减NOx的排放,这使NOx的有用消除成为环保范畴的重要课题.NO2尾气常用NaOH溶液吸收,生成NaNO
-)和c(HNO2)的比值为50.(4)使用如图所示设备(电极均为惰性电极)也可吸收SO2,并用阴极排出的溶液吸收NO
4NO3.25℃时,将amolNH4NO3溶于水,向该溶液滴加bL氨水后溶液呈中性,则滴加氨水的过程中的水的电离平衡将逆向(填”正向”“不”或“逆向”)移动,所滴加氨水的浓度为$\frac{a}{200b}$molL-1.(NH
高中化学来历:题型:选择题13.在容积不变的密闭容器中存在如下可逆反响aA(g)+bB(g)?cC(g)+dD(s)△H=QkJmol

上一篇: 高考化学焚烧热和动力知识点
下一篇: 天然气是清洁能源吗?